Efficacité
Chez les adultes atteints de diabète de type 1, BAQSIMI s’est avéré comparable au glucagon injectable sur le plan de l’efficacité
Efficacité du traitement par BAQSIMI et par le glucagon injectable*

L’efficacité du traitement était évaluée selon le pourcentage de patients ayant présenté soit une hausse de la glycémie à au moins 3,9 mmol/L soit une hausse de la glycémie d’au moins 1,1 mmol/L par rapport au nadir de glycémie dans les 30 minutes ayant suivi l’administration du glucagon.
Le nadir de glycémie était défini comme étant la concentration la plus basse de glucose mesurée au moment de l’administration du glucagon, ou dans les 10 minutes ayant suivi cette administration. Le nadir de glycémie moyen était de 2,5 mmol/L pour BAQSIMI et de 2,7 mmol/L pour le glucagon injectable.
*L’étude IGBC était une étude multicentrique ouverte, avec répartition aléatoire et permutation sur 2 périodes, menée auprès d’adultes atteints de diabète de type 1 (n = 77) afin de comparer l’efficacité d’une dose unique de 3 mg de BAQSIMI à celle d’une dose de 1 mg de glucagon injectable (3 mg) pour le traitement d’une hypoglycémie provoquée par l’administration intraveineuse d’insuline visant l’atteinte d’une glycémie inférieure à 2,8 mmol/L. Le paramètre d’efficacité principal était la proportion de patients chez qui le traitement avait été efficace.
BAQSIMI a commencé à élever la glycémie plasmatique moyenne en à peine 5 minutes*
Variation de la glycémie plasmatique moyenne au fil du temps après l’administration de BAQSIMI
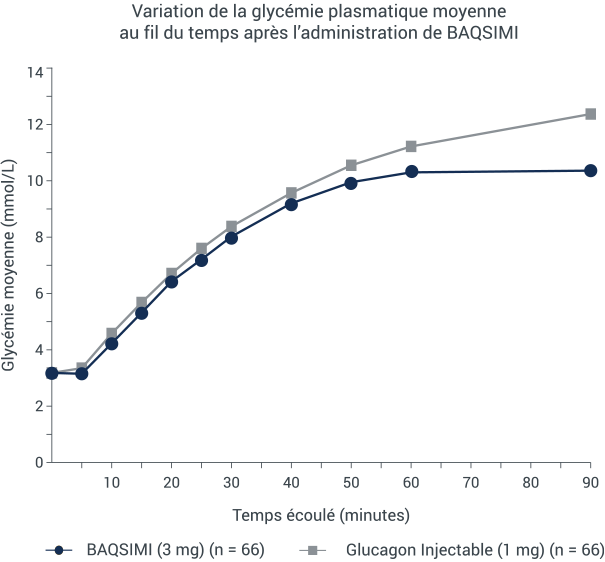
*Une étude multicentrique de détermination de la non-infériorité, avec répartition aléatoire et permutation sur 2 périodes, a été menée auprès d’adultes atteints de diabète de type 1. Une hypoglycémie était provoquée par l’administration intraveineuse d’insuline, puis traitée par le glucagon administré par voie intranasale (3 mg) ou par voie intramusculaire (1 mg). La glycémie plasmatique était mesurée après l’administration de chaque traitement.
La congestion nasale n’a aucun effet sur l’absorption de BAQSIMI

